Περίληψη
Η διαταραχή του μεταβολικού κύκλου στην παθοφυσιολογία του σακχαρώδη διαβήτη τύπου 2 εντός του γαστρεντερικού σωλήνα, που προκαλείται από τη χρόνια κατανάλωση διαιτών υψηλού γλυκαιμικού δείκτη και υψηλής περιεκτικότητας σε λιπαρά, περιλαμβάνει την ενισχυμένη-αυξημένη πέψη και την επακόλουθη αύξηση της απορρόφησης των προϊόντων διάσπασης των υδατανθράκων, των λιπιδίων και των πρωτεϊνών. Η παρατεταμένη αυτή έκθεση των ιστών σε υψηλές συγκεντρώσεις γλυκόζης, ελεύθερων λιπαρών οξέων και αμινοξέων του αίματος, οδηγεί σε αντίσταση των ιστών στη δράση της ινσουλίνης και, σε μεταγενέστερο στάδιο, σε δυσλειτουργία των β-κυττάρων και μείωση της έκκρισης ινσουλίνης. Η υπερινσουλιναιμία που αναπτύσσεται ενισχύει περαιτέρω την πείνα, συντηρώντας τον φαύλο κύκλο της υπερκατανάλωσης τροφής.
Η ενισχυμένη πέψη προϋποθέτει αυξημένη πνευμονογαστρική και ορμονική διέγερση — κυρίως μέσω των ορμονών χοληκυστοκινίνης (CCK) και σεκρετίνης, οι οποίες διεγείρουν την έκκριση χολής και παγκρεατικών υγρών (χοληπαγκρεατική έκκριση).
Εφόσον η ενισχυμένη-αυξημένη πέψη θεωρείται το κεντρικό παθοφυσιολογικό σημείο-στόχος για τη διόρθωση του δυσμεταβολικού κύκλου του σακχαρώδη διαβήτη τύπου 2, προτείνεται ότι η εξειδικευμένη «αντιδιαβητική» χειρουργική θα πρέπει να περιλαμβάνει τα δύο ακόλουθα σκέλη:
- Στελεχιαία πνευμονογαστρική διατομή (truncal vagotomy), για την αναστροφή της αυξημένης παρασυμπαθητικής δραστηριότητας του πνευμονογαστρικού νεύρου.
- Παράκαμψη της διέλευσης της τροφής από το δωδεκαδάκτυλο και το εγγύς έντερο, προκειμένου να αποφευχθεί η υπερβολική διέγερση των κυττάρων που εκκρίνουν χολοκυστοκινίνη και σεκρετίνη — κυττάρων τα οποία είναι ιδιαίτερα άφθονα σε αυτό το τμήμα του εντέρου.
Η «διαβητογόνος» δράση των σύγχρονων διατροφικών προτύπων
Η συσχέτιση της σύγχρονης δυτικού τύπου διατροφής με την αυξημένη επίπτωση χρόνιων μεταβολικών νοσημάτων, όπως η παχυσαρκία και ο σακχαρώδης διαβήτης τύπου 2 (ΣΔτ2), είναι πλέον ευρέως τεκμηριωμένη (1). Η υψηλή κατανάλωση επεξεργασμένων και ραφιναρισμένων τροφίμων, πρόσθετων σακχάρων, καθώς και κορεσμένων και trans λιπαρών, σε συνδυασμό με χαμηλή πρόσληψη φρούτων, λαχανικών, δημητριακών ολικής άλεσης και ξηρών καρπών, έχει συσχετισθεί με αυξημένο κίνδυνο εμφάνισης ΣΔτ2 (2, 3). Η διατροφή με υψηλό γλυκαιμικό δείκτη ή γλυκαιμικό φορτίο, καθώς και αυτή με υψηλή περιεκτικότητα σε λίπος, προδιαθέτουν σε υψηλότερα μεταγευματικά επίπεδα γλυκόζης και ινσουλίνης, στην ανάπτυξη ινσουλινοαντίστασης και, σε μεταγενέστερο στάδιο, στην εμφάνιση σακχαρώδη διαβήτη τύπου 2 (4–8). Η στενή σχέση μεταξύ της σύνθεσης της τροφής και της έναρξης του διαβήτη επιβεβαιώνεται επίσης από πειραματικά δεδομένα σε ζωικά μοντέλα, όπου η υψηλή σε λίπος διατροφή προκαλεί σταθερά ινσουλινοαντίσταση, παχυσαρκία και σακχαρώδη διαβήτη τύπου 2 (9, 10).
Οι παθοφυσιολογικοί μηχανισμοί μέσω των οποίων τα μακροθρεπτικά συστατικά συμβάλλουν στην ανάπτυξη του διαβήτη τύπου 2 αποτελούν αντικείμενο της ερευνητικής μας προσέγγισης και αναλύονται εκτενώς στις επόμενες ενότητες.
Η ενισχυμένη πέψη: το σημείο πυροδότησης του δυσμεταβολικού κύκλου του σακχαρώδη διαβήτη τύπου 2 διαβήτη τύπου 2
Η απορρόφηση των κύριων τύπων διαιτητικών μακροθρεπτικών συστατικών —υδατανθράκων, λιπών και πρωτεϊνών— προϋποθέτει τη διάσπασή τους, μέσω της διαδικασίας της πέψης, σε απορροφήσιμες μορφές: ολιγο- και μονοσακχαρίτες, ελεύθερα λιπαρά οξέα και αμινοξέα, αντίστοιχα (11). Τα ένζυμα του εξωκρινούς παγκρέατος, κυρίως η αμυλάση, η λιπάση, η τρυψίνη και η χυμοτρυψίνη, διαδραματίζουν καθοριστικό ρόλο στη διαδικασία της πέψης. Επιπλέον, διάφορα ένζυμα του λεπτού εντέρου συμμετέχουν στη διάσπαση των μακροθρεπτικών συστατικών, ενώ τα χολικά οξέα —τα κύρια λιπιδικά συστατικά της χολής— είναι απαραίτητα για την πέψη και απορρόφηση των λιπιδίων.
Ο μηχανισμός της χολοπαγκρεατικής έκκρισης προσαρμόζεται στην ποσότητα και στο είδος των διατροφικών συστατικών (12). Είναι γνωστό ότι η έκκριση των ενζύμων που εμπλέκονται στην πέψη πρωτεϊνών, υδατανθράκων και λιπών προσαρμόζεται σε κάθε μεταβολή της πρόσληψης του αντίστοιχου υποστρώματος. Για παράδειγμα, όταν αυξάνεται η πρόσληψη αμύλου, διεγείρεται η ειδική δραστηριότητα της παγκρεατικής αμυλάσης. Κατά συνέπεια, η διατροφή με υψηλό γλυκαιμικό δείκτη ή φορτίο αυξάνει τη δραστηριότητα των παγκρεατικών και εντερικών ενζύμων, οδηγώντας σε ενισχυμένη πέψη (13). Αξίζει να σημειωθεί ότι οι ισχυρότεροι διεγέρτες της παγκρεατικής έκκρισης ενζύμων είναι τα λιπίδια, και ότι η χρόνια χορήγηση δίαιτας υψηλής περιεκτικότητας σε λίπος συνοδεύεται μόνιμα από αυξημένη ενζυμική παραγωγή σε σύγκριση με δίαιτες πλούσιες σε υδατάνθρακες ή πρωτεΐνες (12, 14). Οι δίαιτες υψηλής περιεκτικότητας σε λίπος προκαλούν επίσης αύξηση της έκκρισης των χολικών οξέων.
Συνεπώς, η ενισχυμένη πέψη που προκύπτει από τη χρόνια κατανάλωση διαιτών υψηλής περιεκτικότητας σε λιπαρά και υψηλού γλυκαιμικού δείκτη ή φορτίου αποτελεί κρίσιμο σημείο πυροδότησης του φαύλου δυσμεταβολικού κύκλου που οδηγεί στην ανάπτυξη του σακχαρώδη διαβήτη τύπου 2 (13).
Ερευνητικά δεδομένα υπέρ της ύπαρξης ενισχυμένης πέψης στον σακχαρώδη διαβήτη τύπου 2
I. Αυξημένη παγκρεατική ενζυμική δραστηριότητα στον διαβήτη τύπου 2. Πολλές μελέτες δείχνουν ότι ο σακχαρώδης διαβήτης τύπου 2 διεγείρει την παγκρεατική έκκριση ενζύμων. Στην πολυκεντρική μελέτη LEADER, το 23 % των 9.340 ασθενών με σακχαρώδη διαβήτη τύπου 2 παρουσίαζαν αυξημένα επίπεδα αμυλάσης και λιπάσης νηστείας (15), ενώ παρόμοια αποτελέσματα ανέφεραν και οι Malloy J. et al. (16). Επιπλέον, οι Srihardyastutie A. et al. κατέδειξαν ισχυρή θετική συσχέτιση μεταξύ αυξημένων επιπέδων λιπάσης ορού και HbA1c, ινσουλινοαντίστασης και διάρκειας του διαβήτη (17), ενώ οι Rahman et al. διαπίστωσαν ότι τα επίπεδα αμυλάσης συσχετίζονταν θετικά με τα επίπεδα γλυκόζης αίματος, τη διάρκεια του διαβήτη και τον Δείκτη Μάζας Σώματος (BMI) (18).
Η σημασία της παγκρεατικής ενζυμικής δραστηριότητας επιβεβαιώνεται και από τη χρήση αναστολέων της αμυλάσης και της λιπάσης ως δυνητικών θεραπευτικών εργαλείων για τη διαχείριση του σακχαρώδη διαβήτη τύπου 2 και/ή της παχυσαρκίας. Η φαρμακολογική αυτή παρέμβαση έχει ως αποτέλεσμα μείωση των επιπέδων γλυκόζης αίματος, βελτίωση της ανοχής στη γλυκόζη από το στόμα, επιβράδυνση της εξέλιξης του διαβήτη τύπου 2 και απώλεια σωματικού βάρους (19–23).
II. Αυξημένη δραστηριότητα υδρολυτικών ενζύμων του λεπτού εντέρου στον διαβήτη τύπου 2. Η ύπαρξη αυξημένης ενζυμικής δραστηριότητας δισακχαρασών —όπως της σουκράσης και της ισομαλτάσης— στο λεπτό έντερο τόσο πειραματικών ζώων όσο και ασθενών με σακχαρώδη διαβήτη τύπου 2, έχει τεκμηριωθεί από πληθώρα μελετών τα τελευταία 50 έτη (24, 25). Η χρήση των αναστολέων της α-γλυκοσιδάσης ως θεραπευτικών παραγόντων στη διαχείριση του σακχαρώδη διαβήτη τύπου 2 υπογραμμίζει τη σημαντικότητα της ενζυμικής δραστηριότητας του λεπτού εντέρου στην παθογένεση της νόσου (26).
III. Οι δεσμευτές χολικών οξέων στη θεραπεία του διαβήτη τύπου 2. Πέραν των σημαντικών υπολιπιδαιμικών ιδιοτήτων τους, δεδομένα από πολλές μελέτες υποδεικνύουν ότι οι δεσμευτές χολικών οξέων (bile acid sequestrants) μπορούν επίσης να βελτιώσουν τη γλυκαιμική ρύθμιση σε ασθενείς με σακχαρώδη διαβήτη τύπου 2 (27, 28). Ο κρίσιμος ρόλος των χολικών οξέων στη διαδικασία της πέψης στον σακχαρώδη διαβήτη τύπου 2 καταδεικνύεται από τη χρήση αυτών των φαρμακευτικών παραγόντων όχι μόνο ως ισχυρών υπολιπιδαιμικών μέσων, αλλά και ως θεραπευτικών εργαλείων βελτίωσης του γλυκαιμικού ελέγχου σε ασθενείς με διαβήτη τύπου 2.
Η σημασία της αυξημένης απορρόφησης θρεπτικών συστατικών στον σακχαρώδη διαβήτη τύπου 2.
Η ενισχυμένη πέψη των υδατανθράκων, των λιπών και των πρωτεϊνών οδηγεί σε ενισχυμένη απορρόφηση των αντίστοιχων προϊόντων διάσπασής τους στον σακχαρώδη διαβήτη τύπου 2. Πράγματι, έχει τεκμηριωθεί ότι στον διαβήτη τύπου 2 παρατηρείται αυξημένη απορρόφηση γλυκόζης, καθώς και αυξημένη έκφραση και δραστικότητα των ειδικών μεταφορέων γλυκόζης στα εντεροκύτταρα (29, 30). Επιπλέον, κλινικά δεδομένα έχουν δείξει ότι η εντερική διαπερατότητα και η απορρόφηση λιπιδίων μπορεί επίσης να είναι αυξημένες στον σακχαρώδη διαβήτη τύπου 2. Αν και έως σήμερα το φαινόμενο αυτό έχει αποδοθεί σε διαταραχή της εντερικής μικροβιακής χλωρίδας, εμείς θεωρούμε ότι πρωτίστως, είναι το αποτέλεσμα της ενισχυμένης πέψης των λιπιδίων, η οποία χαρακτηρίζει τη νόσο (31).
Η εγκατάσταση του “σταδίου της ινσουλινοαντίστασης” στον σακχαρώδη διαβήτη τύπου 2
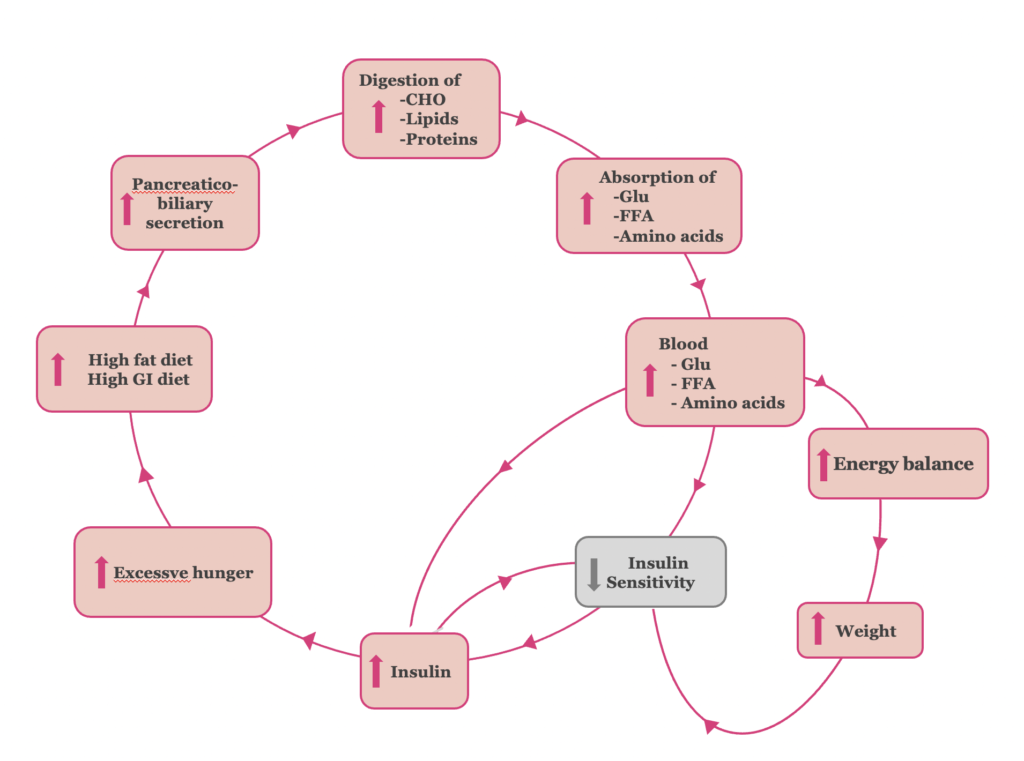
Η χρόνια έκθεση των ιστών σε ενισχυμένη απορρόφηση γλυκόζης, λιπαρών οξέων και αμινοξέων οδηγεί αρχικά σε αντίσταση των ιστών στις δράσεις της ινσουλίνης και, σε μεταγενέστερο στάδιο, σε δυσλειτουργία των β-κυττάρων, μείωση της απελευθέρωσης ινσουλίνης και σακχαρώδη διαβήτη τύπου 2. Προτείνουμε ότι οι κύριοι μηχανισμοί που συμβάλλουν στην αντίσταση στην ινσουλίνη είναι οι ακόλουθοι (Εικόνα 1):
Ι. Αντιρροπιστική υπερινσουλιναιμία. Τα αυξημένα επίπεδα γλυκόζης στο αίμα προκαλούν αντιρροπιστική αύξηση της έκκρισης ινσουλίνης από τα παγκρεατικά β-κύτταρα, προκειμένου να διατηρηθούν φυσιολογικά επίπεδα γλυκόζης στο πλάσμα. Η υπερινσουλιναιμία συμβάλλει με τη σειρά της στην επιδείνωση της ινσουλινοαντίστασης και αντίστροφα (32). Η προσαρμογή των β-κυττάρων στις αυξημένες ανάγκες ινσουλίνης αντιστοιχεί στο αρχικό “στάδιο προσαρμογής” του σακχαρώδη διαβήτη τύπου 2.
ΙΙ. Θετικό ενεργειακό ισοζύγιο και αύξηση σωματικού βάρους. Η υπερβολική πρόσληψη θερμίδων μέσω διαιτών υψηλής περιεκτικότητας σε λίπος και υψηλού γλυκαιμικού δείκτη, σε συνδυασμό με την ενισχυμένη απορρόφηση γλυκόζης, λιπαρών οξέων και αμινοξέων, οδηγεί σε θετικό ενεργειακό ισοζύγιο και αύξηση του σωματικού βάρους. Κατά συνέπεια, εγκαθίσταται η ινσουλινοαντίσταση η επαγόμενη από την παχυσαρκία (33, 34).
ΙΙΙ. Ο ρόλος της υπερινσουλιναιμίας στην υπερκατανάλωση. Η υπερινσουλιναιμία, με τη σειρά της, αυξάνει το αίσθημα της πείνας και τροφοδοτεί την υπερκατανάλωση τροφής (35, 36). Έτσι, ο φαύλος κύκλος του “σταδίου της ινσουλινοαντίστασης” διατηρείται και ενισχύεται, οδηγώντας σταδιακά στην εξέλιξη του σακχαρώδη διαβήτη τύπου 2.
Σχήμα 1. Η παθοφυσιολογία του σταδίου "αντίσταση στην ινσουλίνη" του T2DM.
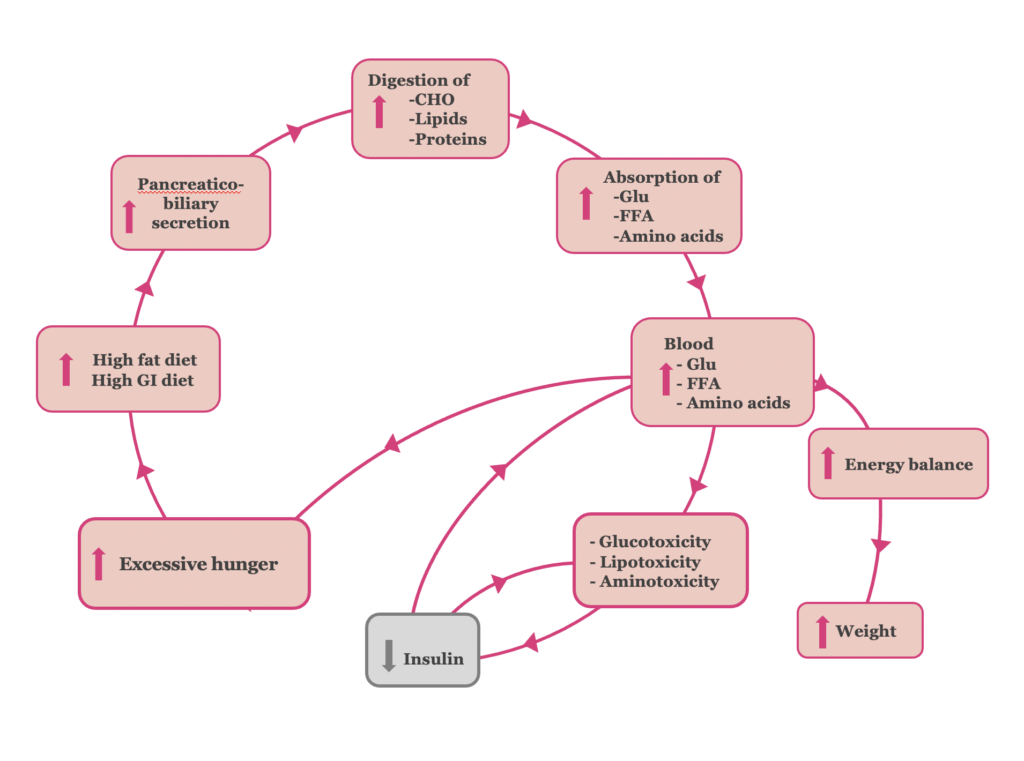
Η εγκατάσταση του«σταδίου δυσλειτουργίας των β-κυττάρων» στον σακχαρώδη διαβήτη τύπου 2
Σε μεταγενέστερο στάδιο, η λειτουργία των παγκρεατικών β-κυττάρων δεν είναι πλέον ικανή να καλύψει επαρκώς τις αυξημένες απαιτήσεις για παραγωγή ινσουλίνης (Εικόνα 2). Η παρατεταμένη υπερδιέγερση των β-κυττάρων και η επακόλουθη «εξάντλησή» τους υπό συνθήκες γλυκοτοξικότητας, λιποτοξικότητας και αμινοτοξικότητας οδηγούν σε δυσλειτουργία των β-κυττάρων και μειωμένη έκκριση ινσουλίνης. Στο στάδιο αυτό της δυσλειτουργίας των β-κυττάρων αναπτύσσεται υπεργλυκαιμία και καθιερώνεται πλέον ο σακχαρώδης διαβήτης τύπου 2 (37, 38).
Ο φαύλος κύκλος του διαβήτη τύπου 2 ολοκληρώνεται, καθώς η υπερβολική πείνα, σύμπτωμα της υπεργλυκαιμίας, οδηγεί σε υπερφαγία.
Σχήμα 2. Η παθοφυσιολογία του σταδίου "δυσλειτουργίας των β-κυττάρων" του T2DM.
Η πέψη: ένα νευροορμονικό γαστρεντερικό μονοπάτι
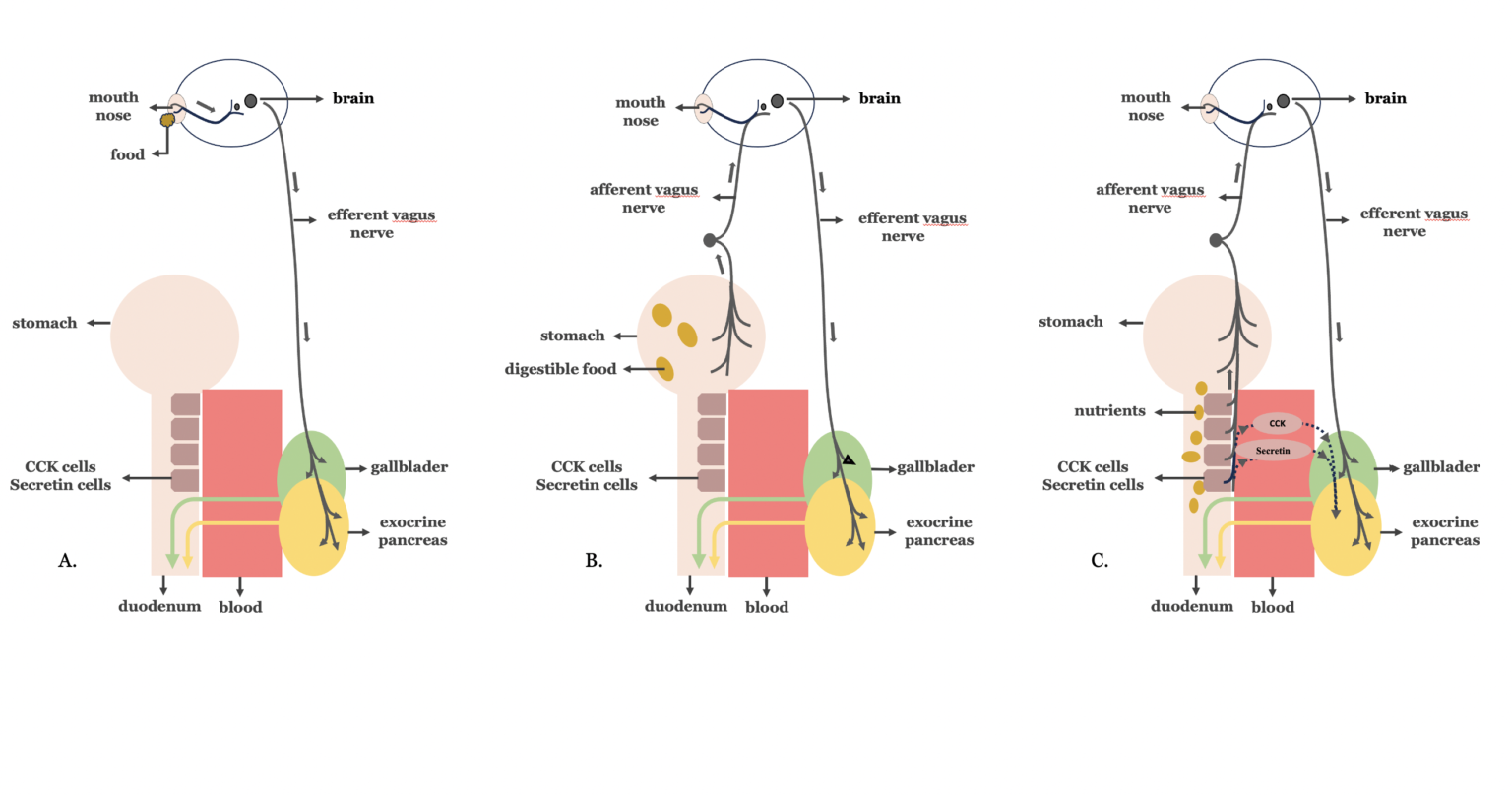
Η χολοπαγκρεατική έκκριση είναι απαραίτητη για τη διαδικασία της πέψης. Διακρίνεται σε τρεις φάσεις —την κεφαλική, τη γαστρική και την εντερική— ανάλογα με την προέλευση των σημάτων που φθάνουν στο πάγκρεας και στη χοληδόχο κύστη (39). Το πνευμονογαστρικό νεύρο, το κύριο στοιχείο του παρασυμπαθητικού νευρικού συστήματος, διαδραματίζει καθοριστικό ρόλο στη ρύθμιση και των τριών φάσεων της χολοπαγκρεατικής έκκρισης. Κατά την κεφαλική φάση (Εικόνα 3Α), σήματα από τους γευστικούς υποδοχείς του στόματος μεταδίδονται μέσω του πνευμονογαστρικού νεύρου προς το πάγκρεας και τη χοληδόχο κύστη. Η γαστρική φάση (Εικόνα 3Β) μεσολαβείται κυρίως από χολινεργικά αντανακλαστικά βραχέων και μακρών κυκλωμάτων τύπου vago-vagal, τα οποία ξεκινούν από τους μηχανοϋποδοχείς διάτασης του στομάχου και καταλήγουν στο πάγκρεας και στη χοληδόχο κύστη. Η εντερική φάση αποτελεί τη σημαντικότερη, καθώς συνεισφέρει έως και το 70 % της μεταγευματικής χολοπαγκρεατικής έκκρισης (Εικόνα 3C). Η φάση αυτή διεγείρεται όταν ο γαστρικός χυμός εισέρχεται στο δωδεκαδάκτυλο. Στο δωδεκαδάκτυλο, τα λίπη και οι πρωτεΐνες διεγείρουν την έκκριση χολοκυστοκινίνης (CCK) από τα κύτταρα που την εκκρίνουν, ενώ το γαστρικό οξύ και τα λιπαρά οξέα που προσλαμβάνονται διεγείρουν την έκκριση σεκρετίνης από τα αντίστοιχα εκκριτικά κύτταρα. Τα κύτταρα αυτά είναι περισσότερο άφθονα στο δωδεκαδάκτυλο και μειώνονται προοδευτικά σε αριθμό στο εγγύς και μέσο τμήμα της νήστιδας.
Η χολοκυστοκινίνη και η σεκρετίνη διεγείρουν την εξωκρινή παγκρεατική έκκριση μέσω άμεσης ορμονικής δράσης στους υποδοχείς των εξωκρινών κυττάρων του παγκρέατος, αλλά και μέσω παρακρινών μηχανισμών, που περιλαμβάνουν εντεροπαγκρεατικά vago-vagal αντανακλαστικά. Επιπλέον, η χολοκυστοκινίνη προκαλεί σύσπαση της χοληδόχου κύστης και έκχυση της χολής στο δωδεκαδάκτυλο, μέσω ενεργοποίησης μακρών αντανακλαστικών τόξων του πνευμονογαστρικού νεύρου (40, 41).
Σχήμα 3. Οι τρεις φάσεις της χολοπαγκρεατικής έκκρισης. Α. Κεφαλική φάση Β. Γαστρική φάση Γ. Εντερική φάση
Συσχέτιση της ενισχυμένης πέψης με την αυξημένη νευροορμονική γαστρεντερική δραστηριότητα στον σακχαρώδη διαβήτη τύπου 2
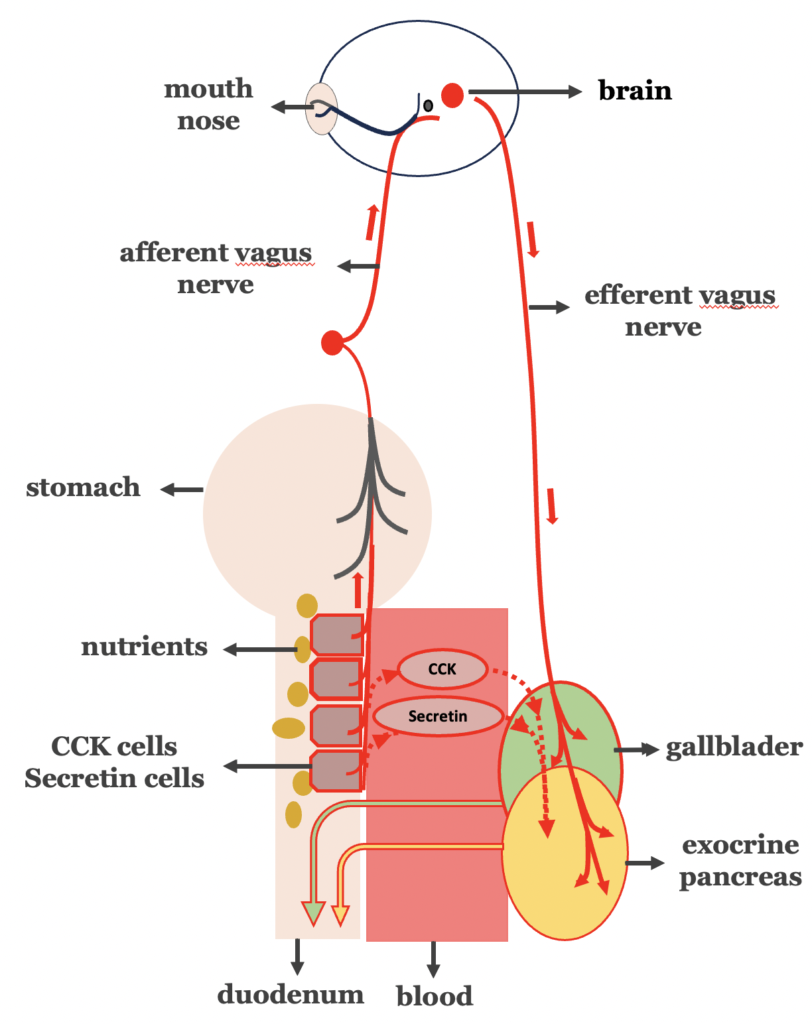
Εάν το κεντρικό βήμα του φαύλου κύκλου στον σακχαρώδη διαβήτη τύπου 2 είναι πράγματι η ενισχυμένη πέψη, και εφόσον η πεπτική διαδικασία ρυθμίζεται τόσο από ορμονικά όσο και από πνευμονογαστρικά νευρικά μονοπάτια, τότε, λογικά, ισχύουν τα εξής (Εικόνα 4):
- Ο σακχαρώδης διαβήτης τύπου 2 θα πρέπει να συνοδεύεται από αυξημένη δραστηριότητα του πνευμονογαστρικού νεύρου.
- Η διατομή του πνευμονογαστρικού νεύρου (truncal vagotomy) θα πρέπει να οδηγεί σε βελτίωση του σακχαρώδη διαβήτη τύπου 2.
- Ο σακχαρώδης διαβήτης τύπου 2 θα πρέπει να συνδέεται με υπερδιέγερση των κυττάρων που εκκρίνουν χολοκυστοκινίνη και σεκρετίνη, οδηγώντας σε αυξημένη ορμονικά διαμεσολαβούμενη χολοπαγκρεατική έκκριση.
- Η παράκαμψη της διέλευσης της τροφής από το δωδεκαδάκτυλο, με αποφυγή της διέγερσης των κυττάρων χολοκυστοκινίνης και σεκρετίνης, θα πρέπει λογικά να οδηγεί σε ύφεση του σακχαρώδη διαβήτη τύπου 2.
Σχήμα 4. Υπερδιέγερση της εντερικής φάσης της χολοπαγκρεατικής έκκρισης στον διαβήτη τύπου 2.
Μετά από μια ενδελεχή ανασκόπηση της βιβλιογραφίας, παρουσιάζουμε τα ακόλουθα εντυπωσιακά ευρήματα:
A. Αυξημένη δραστηριότητα του πνευμονογαστρικού νεύρου στο «στάδιο της ινσουλινοαντίστασης» του σακχαρώδη διαβήτη τύπου 2
Η σχέση μεταξύ παχυσαρκίας, υπερινσουλιναιμίας –ως χαρακτηριστικού του σταδίου της ινσουλινοαντίστασης στον σακχαρώδη διαβήτη τύπου 2– και υπερδραστηριότητας του παρασυμπαθητικού νευρικού συστήματος έχει τεκμηριωθεί ήδη από τη δεκαετία του 1980. Ο Rohner-Jeanrenaud F., πρωτοπόρος ερευνητής στον τομέα αυτό, απέδειξε ότι η αυξημένη έκκριση ινσουλίνης σε πειραματικό μοντέλο παχυσαρκίας διαμεσολαβείται κυρίως από αυξημένο τόνο του πνευμονογαστρικού νεύρου, ο οποίος δρα άμεσα στα β-κύτταρα (42–44). Αργότερα, ερευνητικά δεδομένα απέδωσαν την εγκατάσταση και διατήρηση της υπερινσουλιναιμίας σε ανισορροπία του αυτόνομου νευρικού συστήματος, που περιλαμβάνει αυξημένη παρασυμπαθητική και μειωμένη συμπαθητική δραστηριότητα στο γαστρεντερικό νευρικό σύστημα (45, 46).
B. Η διατομή του πνευμονογαστρικού νεύρου (truncal vagotomy) για τη βελτίωση της ευαισθησίας στην ινσουλίνη στον σακχαρώδη διαβήτη τύπου 2
Τα παραπάνω ευρήματα συμφωνούν με ερευνητικά δεδομένα που δείχνουν ότι η διατομή του πνευμονογαστρικού κορμού (truncal vagotomy), όταν εκτελείται ως αυτόνομη χειρουργική πράξη για τη θεραπεία της νοσογόνου παχυσαρκίας, οδηγεί σε ομαλοποίηση των επιπέδων ινσουλίνης και αποκατάσταση της ευαισθησίας στην ινσουλίνη (42, 47–49). Επιπλέον, η διατομή του πνευμονογαστρικού νεύρου έχει συστηματικά συσχετισθεί με μείωση της όρεξης, ελάττωση της πρόσληψης τροφής και απώλεια σωματικού βάρους σε άτομα με σοβαρή παχυσαρκία (50). Ήδη από το 1978, η truncal vagotomy έχει προταθεί ως ενδεχόμενη θεραπευτική προσέγγιση για την παχυσαρκία, ωστόσο έως σήμερα δεν έχει χρησιμοποιηθεί συστηματικά για τον σκοπό αυτό (51).
C και D. Οι επεμβάσεις παράκαμψης του εγγύς εντέρου είναι οι πιο αποτελεσματικές για την ύφεση του σακχαρώδη διαβήτη τύπου 2 πιο αποτελεσματικό για την ύφεση του διαβήτη τύπου 2.
Η άμεση συμβολή του εγγύς εντέρου (δωδεκαδάκτυλο και εγγύς νήστιδα) στην ανάπτυξη του σακχαρώδη διαβήτη τύπου 2 προτάθηκε αρχικά από τον Rubino και τους συνεργάτες του, με βάση πειράματα σε διαβητικούς αρουραίους (52, 53). Τα πειράματα αυτά αποκάλυψαν ότι ο αποκλεισμός της διέλευσης των θρεπτικών συστατικών από το δωδεκαδάκτυλο στους διαβητικούς αρουραίους βελτίωσε σημαντικά την ανοχή στη γλυκόζη, ενώ η αποκατάσταση της διέλευσης από το ίδιο τμήμα του εντέρου επανέφερε τη διαταραγμένη ανοχή!
Πλήθος κλινικών μελετών σε ανθρώπους έχουν δείξει ότι οι βαριατρικές επεμβάσεις που περιλαμβάνουν παράκαμψη του εγγύς εντέρου είναι σαφώς πιο αποτελεσματικές στην επίτευξη ύφεσης του διαβήτη, σε σύγκριση με εκείνες που δεν την περιλαμβάνουν. Σε ανάλυση 23.106 ασθενών με μεταβολικό σύνδρομο, τα ποσοστά ύφεσης του σακχαρώδη διαβήτη τύπου 2 ήταν πολύ υψηλότερα μετά από γαστρική παράκαμψη και χολιοπαγκρεατική εκτροπή (62% και 74%, αντίστοιχα), σε σύγκριση με τη γαστρεκτομή sleeve και το γαστρικό δακτύλιο (52% και 28%, αντίστοιχα), μετά από ένα έτος παρακολούθησης (54).
Παρόμοια αποτελέσματα έχουν αναφερθεί και από άλλους ερευνητές, τόσο σε αναδρομικές (55) όσο και σε προοπτικές μελέτες (56), μετά από 2 και 3 έτη παρακολούθησης, αντίστοιχα. Ακόμη και σε μελέτες με 5 και 8 έτη παρακολούθησης, η γαστρική παράκαμψη παρέμεινε ανώτερη της γαστρεκτομής sleeve, όχι μόνο ως προς τα ποσοστά ύφεσης του διαβήτη, αλλά και ως προς τα ποσοστά υποτροπής του (57–59).
Συμπέρασμα
Σύμφωνα με τη θεωρία μας (13), το κρίσιμο βήμα του δυσμεταβολικού κύκλου στην παθοφυσιολογία του σακχαρώδη διαβήτη τύπου 2 στο γαστρεντερικό σωλήνα, που προκύπτει από τη χρόνια υπερκατανάλωση τροφών υψηλής περιεκτικότητας σε λίπος και υψηλού γλυκαιμικού δείκτη/φορτίου, είναι η ενισχυμένη-αυξημένη πέψη των θρεπτικών συστατικών, η οποία οδηγεί σε αυξημένη εντερική απορρόφηση. Η ενισχυμένη πέψη προϋποθέτει αυξημένη χολοπαγκρεατική έκκριση, η οποία με τη σειρά της εξαρτάται από αυξημένη πνευμονογαστρική και ορμονικώς (χολοκυστοκινίνη και σεκρετίνη) διαμεσολαβούμενη διέγερση.
Αντιμετωπίζοντας την ενισχυμένη πέψη ως το κύριο θεραπευτικό στόχο για τη διόρθωση του δυσμεταβολικού κύκλου του σακχαρώδη διαβήτη τύπου 2, προτείνουμε ότι μια εξειδικευμένη αντιδιαβητική χειρουργική προσέγγιση θα πρέπει να περιλαμβάνει: a. Διατομή του πνευμονογαστρικού νεύρου (truncal vagotomy), με σκοπό την αναστροφή της αυξημένης παρασυμπαθητικής δραστηριότητας, και b. Παράκαμψη του εγγύς εντέρου (δωδεκαδάκτυλο και εγγύς νήστιδα), ώστε να αποφεύγεται η υπερδιέγερση των κυττάρων χολοκυστοκινίνης και σεκρετίνης από τα θρεπτικά συστατικά. Η θεωρία μας, με τίτλο «Metabolic effects of truncal vagotomy when combined with bariatric–metabolic surgery», δημοσιεύθηκε το 2022 σε ένα από τα κορυφαία εξειδικευμένα περιοδικά, το Metabolism (13).
Η κλινική μελέτη VagusSx συνδυάζει αυτές τις δύο παρεμβάσεις σε μία, με στόχο την επίτευξη μακροχρόνιας πλήρους ύφεσης του σακχαρώδη διαβήτη τύπου 2. Ελπίζουμε ότι στο μέλλον, η μείωση της πέψης ως μέσο βελτίωσης της θεραπείας του σακχαρώδη διαβήτη, θα μπορεί να επιτυγχάνεται με ηπιότερες και λιγότερο επεμβατικές μεθόδους.